목차
Objectives of the guideline
유럽연합, 일본 및 미국 3개 지역에 허가 신청을 하기에 충분한 새로운 원료의약품 또는 완제의약품의 안정성 시험자료 규정, 기타 국가에서의 등록 또는 수충을 위한 안정성 시험은 미포함한다.
Scope of the guideline
신약 성분 및 관련 완제의약품 허가 신청 (약식 허가신청, 변경 신청, 임상시험 신청등은 제외) 새로운 제형 및 생명공학 -> Q1C, 생물학적 완제의약품 -> Q5C
General Principles
안정선 시험의 목적 : 온도, 습도, 빛 등 다양한 환경 요인에 따라 DS 및 DP의 품질이 시간 흐름에 따라 어떻게 변하는가에 대한 근거를 제공한다. (DS : re-test date & DP : shlef life (Expiration date) 및 보존 조건 설정)
시험 조건 : 유럽연합, 일본, 미국 3개 지역의 기후 조건의 영향 분석을 바탕으로하고 기후 구역 I 및 II를 대상으로 한다.
Drug Substance
General
원료 의약품에 대한 안정성 정보는 체계적인 안정성 평가의 필수적인 부분
Stress Testing(가혹시험)
가혹 조건하에서의 의약품의 분해 과정 및 분해 산물 등을 확인하기 위한 시험으로 단일 배치로 실시할 수 있다. 안정성과 관련있는 시험이다.
| Stress factor | Conditions |
| Heat | 10°C 증가 |
| Humidity | 75% RH or 그 이상 |
| Acid | 0.1N HCl |
| Base | 0.1N NaOH |
| Oxidative | 3% H2O2 |
| Photolytic | Xenon, Metal halide lamp 또는 Near UV, white florescent lamp |
Selection of Batch(배치 선정)
Contatiner Closure Systems(용기 마개 시스템)
안정선 시험은 설정한 보존 및 유통용 포장과 동일하거나 그 포장을 시뮬레이션한 용기 마개시스템으로 포장된 원료의약품에 대해 실시한다.
Specification(규격)
Testing Frequency(시험 주기) - Long, Accelerated, Intermediate로 총 3가지
Long Term : 안정성 프로파일 확립하기 충분한 테스트 기간을 선정
Accelerated Storage Conditoin : 최초 6개월 (최소 3회, 최초와 최종 시험 포함 3개 시점), 유의적인 변화가 예측될 경우 시험을 확대 실시 (4번째 시점 추가)
Intermediate Storage Condition : 가속 시험에서 유의적인 변화 발생 시 진행, 12개월 시험에서 최초/최종 시험 포함 최소 4개 시점
Storage Conditions
열 안정성 및 습도에 대한 민감성을 시험 할 수 있는 보관 조건 하에서 평가한다. 보관 조건과 시험 기간은 보관, 운송 및 사용을 감안하여 선정한다. 장기 시험은 제출 시점에 최소 3개 초기 배치에 대한 최소 12개월 시험을 포함한다. 가속 시험 결과와 중간 조건 시험 결과는 보관 조건을 일시적으로 벗어나는 상황의 영향을 평가하는데 사용 가능하다.
| 시험 | 보관 조건 | 시험 주기 | 최소기간 |
| 장기 | 25°C +-2°C / 60% RH +- 5%RH 30°C +-2°C / 65% RH +- 5%RH |
0,3,6,9,12,18,24,36 개월 | 12개월 |
| 중간 | 30°C +- 2°C / 65% RH +-5%RH | 0,6,9,12 개월 | 6개월 |
| 가속 | 40°C +-2°C / 75% RH +- 5%RH | 0,3,6 개월 | 6개월 |
30°C +-2°C / 65% RH +- 5%RH 경우는 중간 조건이 불필요하다. 가속 시험 조건에서 6개월 시험 기간 이내 어느 시점에서 “유의적인 변화(기준을 벗어나는 결과)”가 발생한다. 중간 시험 조건에서는 추가 시험을 실시한다.
| 시험 | 보관 조건 | 근거 자료의 최소 기간 |
| 장기 | 5°C +- 3°C | 12개월 |
| 가속 | 25°C +-2°C / 60% RH +- 5%RH | 6개월 |
| 시험 | 보관 조건 | 근거 자료의 최소 기간 |
| 장기 | +20°C +- 5°C | 12개월 |
Stability Commitment
장기 안정성 시험 자료가 승인 시험에 예정 재시험 기간을 포함하지 못할 경우, 재시험 기간 확실히 설정하기 위해 승인 이후에 안정성 계속 진행 이행을 약속한다.
(1) 최소 3개 생산 배치 안정성 시험 자료 보유 -> 예정 재시험 기간 까지 시험들을 계속 진행
(2) 3개 미만의 생산 배치 안정성 시험 자료 보유 -> 예정 재시험 기간까지 시험 지속, 최소 총 3개가 되도록 생산 배치 추가, 예정 재시험 기간까지 장기 안정성 시험 실시
(3) 안정성 시험 자료를 갖추고 있지 않을 경우 -> 최초 3개 생산 배치에 대해 예정 재시험 기간까지 장기 안정성 시험을 실시
Evaluation
Statements/Labelling
Drug Products
General
안정성 시험의 설계는 원료의약품의 특성에 대한 지식과 안정성 시험으로부터의 얻은 지식 및 제형에 관한 임상 연구로부터 얻은 경험을 바탕으로 진행된다.
Photostability Testing
최소 1개의 초기 배치 완제의약품을 실시, 시험의 표준 조건은 ICH Q1B
Selection of Batch
최소 3개의 초기 배치에 대해 제출한다.
3개 배치 중 2개 배치는 적어도 파일럿(pilot)규모,나머지 1개는 정당한 사유 있는 경우 더 작은 규모 가능.
초기 배치는 판매 예정 용기 마개 시스템과 동일한 것으로 한다.
초기 배치용 제조 공정은 실 생산 배치를 시뮬레이션 한 것, 판매용과 동일한 품질과 규격을 가지는 제품을 생산한다. 가능한 경우, 완제 의약품의 배치는 원료 의약품의 다른 배치를 사용하여 제조한다.
브래킷법/매트릭스법이 적용되는 경우가 아니면, 완제의약품의 함량과 용기 크기 별로 각각 실시한다.
Container Closure System
판매 예정 용기 마개 시스템으로 포장한 제형에 대해 실시하는데 필요 시 2차 포장 과 용기 라벵을 포함한다.
Specification
규격 : 시험 항목, 분석 방법의 참조 사항 및 예정 허용 기준의 목록
보존 기간 동안 변하기 쉽고, 품질, 안전성 및/또는 유효성에 영향을 줄 가능성이 있는 완제의약품의 특성에 대한 시험을 포함한다.
- 물리적, 화학적, 생물학적 및 미생물학적 특성, 보존제(항산화제, 항균제) 및
성능시험 포함 (예, 약물 전달 체계)
- 밸리데이션 완료된 분석방법으로 실시
Testing Frequency
Drug Substance와 동일하다.
Storage Conditions
Drug Substance와 동일하다.
Significant Change
(1) 분석 결과, 초기 값에 대비 함량 5% 변화
생물학적 또는 면역학적 방법으로 역가 평가할 때,
역가가 허용 기준을 충족하지 못하는 경우
(2) 분해 산물이 허용 기준을 초과하는 경우
(3) 성상, 물리적 특성, 성능 시험 (예, 색, 상분리, 재현탁성, 경도 등) 의 허용 기준
벗어나는 경우
가속조건에서는 일부 물리적 특성의 변화 (예, 좌약의 연화, 크림의 융해) 예상
(4) pH 허용 기준을 충족하지 못하는 경우
(5) 용출 허용 기준을 충족하지 못하는 경우
불투과 용기에 포장된 완제 의약품
습기 또는 용매 통과 영구적 차단 불투과용기에 포장된 완제의약품은 습기 감수성이나 용매 손실 가능성이 문제되지 않는다.
반투과 용기에 포장된 완제 의약품
• 반투과 용기에 포장되는 수성 액상 제제는 물리적, 화학적, 생물학적 및 미생물학적 안정성 뿐 아니라 수분 손실 가능성을 평가한다. 낮은 상대 습도 조건하에서 실시
• 반투과 용기에 보관되는 수분을 기제로 하는 완제의약품은 상대습도가 낮은 환경에서 견딜 수 있음을 입증이 필요하다.
반투과 용기에 포장된 완제 의약품
| 시험 | 보관 조건 | 근거 자료의 최소 기간 |
| 장기 | 25°C +-2°C / 40% RH +- 5%RH 30°C +-2°C / 35% RH +- 5%RH |
12개월 |
| 중간 | 30°C +- 2°C / 65% RH +-5%RH | 6개월 |
| 가속 | 40°C +-2°C / 25% RH 이하 | 6개월 |
40°C/25%RH 이하에서 3개월 동안 보존 후, 초기 값으로 부터 5%의 수분이 손실된 경우, 유의적인 변화로 간주한다.
30°C ± 2°C / 35% RH ± 5% RH 경우 중간 조건 불필요
25°C ± 2°C / 40% RH ± 5% RH 실시
가속 시험 조건에서 6개월 시험 기간 동안 수분 손실 이외에 “유의적인 변화”가 발생하면 30도에서 온도에 대한 영향 평가 위해 추가적 중간 조건 시험 실시한다. 작은 용기(1 mL 이하) 또는 단위 용량 제품은 5% 수분 손실이 있어도 정당한 사유가 있다면 인정 가능하다.
냉장보관 완제 의약품
| 시험 | 보관 조건 | 근거 자료의 최소 기간 |
| 장기 | 5°C +- 3°C | 12개월 |
| 가속 | 25°C +-2°C / 60% RH +- 5%RH | 6개월 |
가속 조본 조건에서 3개월과 6개월 사이에 유의적인 변화가 발생하면 예정 사용기간은 장기 보존 시험 자료를 기초로 한다. 최초 3개월 내 유의적인 변화 발생시 계속 진행하는 것은 불필요하다.
냉동보관 완제 의약품
| 시험 | 보관 조건 | 근거 자료의 최소 기간 |
| 장기 | +20°C +- 5°C | 12개월 |
가속 시험 조건이 없는 경우는 적절한 기간동안 상승된 온도 조건에서 단일 배치에 대한 시험을 실히해 라벨 표시 보존 조건을 일시적으로 벗어나는 경우에 따른 영향을 평가한다.
-20°C 이하 보관 완제 의약품에 대해서는 별도의 기준을 정한다.
Stability Commitment
Drug Substance와 동일하다.
Evaluation
안정성 정보의 표시 및 평가에 있어서는 체계적인 접근 필요하다. - 필요에 따라 제형의 특별한 속성 (예, 용출률)을 포함, 물리적, 화학적, 생물학적 및 미생물학적 시험결과 포함
안정성 시험의 목적은 최소 3개 배치의 완제 의약품에 대한 시험을 바탕으로, 개별 배치의 편차 정도는 향후 유사한 환경에서 제조 및 보관될 완제의약품의 모든 배치에 적용할 수 있게 유효기간 설정한다.
개별 배치의 편차는 생산될 배치가 유효기간 동안 기준을 만족할 것인가에 대한 신뢰성을 판단한다.
Degradation 및 Variability가 매우 적은 결과를 보일 경우에는 신청한 유효기간을 부여 받을 수 있다. (이 경우 사유가 정당하면 정식 통계 분석 생략 가능)
시간에 따른 변화가 예상되는 정량적 특성의 분석은 통계적 검정을 통해 진행 가능하다.
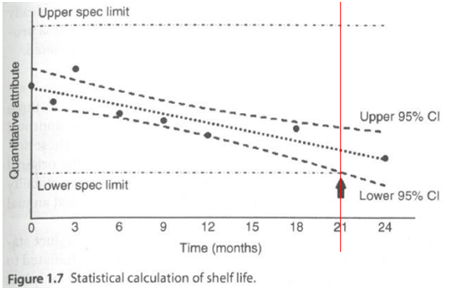
시간 경과에 따라 정량 결과가 감소하는 경우, 95% 하한 신뢰 한계인 21개월 시점에 하한 허용 기준(Low spec. limit)에 도달한다. 정량 결과의 통계 분석을 통해 신청한 사용기간 24개월을 입증할 수 없고 21개월 까지 허용될 수 있다.
Staemens / Labelling
라벨에 기재되는 보관 조건는 안정성 평가를 바탕으로 해당 국가/지역의 요구사항에 따라 정한다. 특히 냉동에 취약한 완제의약품의 경우, 특정한 지시 사항 표시하는데 “대기 조건” 또는 “실온” 과 같은 용어 사용을 금지한다.
유효기간 만료일은 용기 라벨 표시




